Latihan 6
CHAPTER 13
Konstanta laju reaksi orde pertama adalah 4,6 × 10-⁴ s-¹ pada 350 ° c. jika energi aktivasi adalah 104 kj / mol, hitung suhu di mana laju konstannya adalah 8,80 × 10-⁴ s-¹!
Jawaban :
CHAPTER 14
Proses kesetimbangan berikut telah dipelajari pada 230 ° C:
2NO(g) + O2(g) ßà 2NO2(g)
Dalam satu percobaan, konsentrasi spesies yang bereaksi pada kesetimbangan ditemukan [NO] = 0,0542 M, [O2] = 0,127 M, dan [NO2] = 15,5 M. Hitung konstanta kesetimbangan (Kc) reaksi pada suhu ini.
Jawab:
Konstanta kesetimbangan diberikan dengan
Mengganti konsentrasi, kita menemukan itu
CHAPTER 15
Jawaban :
(a) Asam-asam ini semuanya memiliki struktur yang sama, dan semua halogen memiliki struktur yang sama bilangan oksidasi (11). Karena elektronegativitas menurun dari Cl ke I, atom Cl paling banyak menarik pasangan elektron yang dibaginya dengan atom O. Akibatnya, ikatan O¬H adalah yang paling polar di HClO dan paling sedikit di HIO. Dengan demikian, kekuatan asam berkurang sebagai berikut:
(b) Struktur HNO3 dan HNO2 pada bilangan oksidasi N adalah 15 di HNO3 dan 13 di HNO2, HNO3 adalah asam yang lebih kuat dari HNO2
CHAPTER 16
Sebanyak 40 mL larutan asam sulfat 0,25 M dititrasi dengan suatu basa bervalensi satu, dan ternyata dibutuhkan 57 mL basa tersebut. Berapakah kemolaran basa yang digunakan tersebut?
Jawab:
Reaksi netralisasi terjadi antara asam sulfat H2SO4 (asam kuat bervalensi dua) dengan suatu basa bervalensi satu.
CHAPTER 17
CHAPTER 18
Tulis persamaan ionik yang seimbang untuk merepresentasikan oksidasi ion iodida (I2) oleh ion permanganat (MnO4 2) dalam larutan basa untuk menghasilkan molekul yodium (I2) dan mangan (IV) oksida (MnO2)
Jawab:
Langkah 1: Persamaan tak seimbang adalah
MnO4- + I- àMnO2 + I2
Langkah 2: Dua setengah reaksi adalah
-1 0
Oksidasi: I- à I2
+7 +4
Reduksi: MnO4- à MnO2
Langkah 3: Kami menyeimbangkan setiap setengah- reaksi untuk jumlah dan jenis atom dan muatan. Oksidasi setengah reaksi: Pertama kita menyetarakan atom I:
2I- à I2
Untuk menyeimbangkan muatan, kita menambahkan dua elektron ke sisi kanan persamaan:
2I- à I2 + 2e-
Reduksi setengah reaksi: Untuk menyeimbangkan atom O, kita tambahkan dua molekul H2O di kanan:
MnO4- à MnO2 + 2H2O
Untuk menyeimbangkan atom H, kita tambahkan empat ion H1 di kiri:
MnO4- + 4H+ à MnO2 + 2H2O
Ada tiga muatan positif bersih di sebelah kiri, jadi kita tambahkan tiga elektron ke sisi yang sama untuk menyeimbangkan muatan:
MnO4- + 4H+ + 3e- à MnO2 + 2H2O
Langkah 4: Sekarang kita tambahkan setengah reaksi oksidasi dan reduksi untuk menghasilkan reaksi keseluruhan. Untuk menyamakan jumlah elektron, kita perlu mengalikan oksidasi setengah reaksi dengan 3 dan reduksi setengah reaksi dengan 2 sebagai berikut:
Elektron di kedua sisi saling meniadakan, dan tersisa persamaan ionik bersih yang seimbang:
6I- + 2MnO4- + 8H+ à 3I2 + 2MnO2 + 4H2O
Ini adalah persamaan yang seimbang dalam media asam. Namun, karena reaksi dilakukan dalam media basa, untuk setiap ion H1 kita perlu menambahkan jumlah ion OH2 yang sama ke kedua sisi persamaan:
6I- + 2MnO4- + 8H+ + 8OH- à 3I2 + 2MnO2 + 4H2O + 8OH-
Akhirnya , menggabungkan ion H1 dan OH2 untuk membentuk air, kita memperoleh
6I- + 2MnO4- + 4H2O à 3I2 + 2MnO2 + 8OH-
Langkah 5: Pemeriksaan terakhir menunjukkan bahwa persamaan seimbang dalam hal atom dan muatan.
Kuis 6. Kerjakan 1 Problem (Chapter 13 s/d 18)
CHAPTER 13
CHAPTER 14
CHAPTER 15
Berapa gram Na2CO3 yang diperlukan untuk membuat 100 ml larutan Na2CO3 0,01 M (Ar Na= 23)?
Mol Na2CO3 = 0,01 x 0,1 = 0,001 mol
Massa Na2CO3 = mol Na2CO3 x Mr
Massa Na2CO3 = 0,001 x 106 = 0,106 gr
CHAPTER 16
pKa dari asam butirat (HBut) adalah 4,7. Hitunglah Kb untuk ion butirat (But-)
CHAPTER 17
CHAPTER 18
Hitung ggl standar sel yang menggunakan reaksi setengah sel Ag / Ag+ dan Al / Al+3. Tuliskan reaksi sel yang terjadi dalam kondisi keadaan standar.
Jawab:
Esel = EAg – EAl
= 0,8 - (-1,66)
= +2,46
Persamaan: (Oksidasi) Al àAl+3 + 3e-
(Reduksi) Ag+ + e- à AgpKa dari asam butirat (HBut) adalah 4,7. Hitunglah Kb untuk ion butirat (But-)
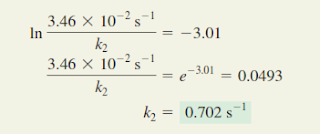





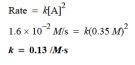




Tidak ada komentar:
Posting Komentar